Saat duduk di bangku kelas 10 SMA tentu akan mendapatkan materi mengenai teori atom, seperti pengertian, jenis, dan aspek lain yang berhubungan dengan teori dan model atom tersebut. Memahami juga perkembangan teori atom di Dunia ini.
Khususnya bagi kamu yang saat memasuki jenjang perkuliahan jurusan kimia menemukan mata kuliah dengan materi atom di dalamnya. Jadi, tidak semua anak kuliah bisa mengulang kembali materi ini. Sedangkan untuk kamu yang kemudian memutuskan menjadi dosen atau guru, maka ada kemungkinan mencari materi mengenai atom.
Yakni untuk dijadikan sebagai referensi dalam menyiapkan materi atau bahan ajar. Sebab menyusun bahan ajar tidak cukup hanya mengandalkan daya ingat. Melainkan juga harus diperkuat dengan sumber-sumber yang relevan dan berkualitas. Sebab bisa jadi ilmu atau materi mengenai teori atom sudah berkembang.
Sehingga penjelasan mengenai teori ini sudah berbeda dengan penjelasan ketika masih sekolah dulu. Jadi, dosen dan guru pun perlu mencari referensi terbaru agar relevan. Mahasiswa dan siswa yang diberi materi fisika maupun kimia ini kemudian bisa mendapatkan materi yang “segar”. Jadi, apa itu teori mengenai atom? Simak informasi lengkapnya di bawah ini.
Daftar Isi
Pengertian Atom
Sebelum mulai mempelajari apa itu teori atom dan perkembangannya, maka terlebih dahulu perlu memahami dulu pengertian dari atom itu sendiri. Atom secara etimologi atau asal kata berasal dari bahasa Yunani “atomos”. Arti dari kata tersebut adalah “tidak bisa dipotong”.
Dilihat dari asal katanya, kemudian atom diketahui memiliki definisi sebagai suatu partikel yang menyusun suatu benda dan memiliki ukuran sangat kecil. Sedangkan dilansir dari situs kompas.com dijelaskan bahwa atom merupakan partikel terkecil di dalam semesta dan definisi ini dicetuskan oleh Demokritos di masa Yunani Kuno.
Pengertian dari atom kemudian terus berkembang dan hal ini menjadi bagian dari perkembangan teori terhadap atom itu sendiri yang nanti akan dibahas mendetail di bawah. Sebagai bagian atau partikel terkecil, maka atom kemudian tidak bisa dipotong atau diperkecil lagi.
Atom kemudian tersusun atas beberapa partikel, dan kemudian ada istilah subatom. Hal ini menunjukan betapa kecilnya ukuran atom di setiap permukaan benda apapun. Menentukan ukuran atom kemudian menjadi hal yang tidak mudah. Sebab dalam satu tanda titik dari sebuah tulisan atau benda saja sudah tersusun dari jutaan atom.
Perkembangan Teori Atom
Melalui penjelasan di atas tentu diketahui bahwa kata atom berasal dari istilah bahasa Yunani yang memiliki arti sebagai komponen terkecil yang tidak bisa dipisah-pisah lagi. Konsep atom ini pertama kali diajukan oleh seorang filsuf dari India dan juga dari Yunani. Konsep ini kemudian terus berkembang, hingga pada abad ke-17 sampai abad ke-18.
Pada abad tersebut semakin banyak kimiawan yang kemudian menemukan sejumlah zat yang komponennya sangat kecil. Saking kecilnya hingga tidak bisa dipecah atau dipisahkan lagi menggunakan metode kimia.
Kemudian di akhir abad ke-19 dan awal abad ke-20, konsep bahwa atom merupakan partikel terkecil dan tidak dapat dibagi lagi mengalami perubahan. Sebab para fisikawan di masa tersebut berhasil menemukan komponen struktur atom. Yakni terdapat subatom di di dalam sebuah atom. Sehingga atom bukan lagi partikel kecil yang tidak bisa dibagi.
Supaya lebih paham mengenai perkembangan dari teori atom atau konsep definisi dari atom tersebut. Maka perlu mengenal perkembangannya seperti apa, dan kemudian akan dijumpai beberapa teori mulai dari awal teori tentang atom dicetuskan sampai teori modern. Berikut adalah penjelasannya:
1. Teori Atom Dalton (John Dalton)
Teori yang pertama mengenai atom dikemukakan oleh John Dalton pada tahun 1803. Teori ini kemudian diyakini sebagai teori yang benar dan berlaku hingga tahun 1805. Dalton kemudian dikenal sebagai ilmuwan pertama yang mengemukakan mengenai teori atom dan kemudian sosoknya dikenal dunia hingga sekarang.
Dalton memiliki hipotesis mengenai model atau tampilan fisik atom yang berupa bola pejal. Mirip dengan bola yang digunakan dalam olahraga tolak peluru. Dalton juga menyampaikan bahwa teori bentuk fisik atom ini didasarkan pada beberapa hal, yaitu:
- Semua benda yang ada di dunia terbuat dari atom yang saling terkait atau terhubung satu sama lain.
- Atom-atom yang menyusun suatu benda kemudian tidak dapat dipecah atau dibagi lagi menjadi partikel lebih kecil.
- Atom-atom juga tidak dapat diciptakan maupun dihancurkan.
- Atom-atom dari unsur tertentu adalah identik satu sama lain, sehingga membuat satu unsur berbeda dengan unsur lainnya.
- Perubahan atau reaksi kimia merupakan suatu proses penggabungan maupun pemisahan dari atom-atom yang tidak dapat dibagi atau dipisahkan lagi.
kelebihan teori atom dalton adalah dapat menciptakan perkembangan model atom pertama sehingga para ilmuwan lain bisa melakukan pengembangan sekaligus perbaikan dari teori yang ditemukan oleh Dalton.
Sedangkan, kelemahan teori atom Dalton adalah tidak dapat menjelaskan kenapa atom bisa menghantarkan arus listrik padahal memiliki bentuk bola pejal. Kelemahan inilah yang kemudian mendorong ilmuwan dan fisikawan lain untuk mencari celah dan menyempurnakan teorinya.
2. Teori Atom Thomson (Sir Joseph John Thomson)
Teori atom pun terus berkembang, hingga pada awal abad ke-20, William Crookes dan J.J Thomson menemukan katode yang lebih baik. Penelitian mengenai katode kemudian dilakukan lebih lanjut, salah satunya meneliti cahaya katode tersebut. Cahaya katode ini kemudian disimpulkan sebagai sebuah partikel.
Sebab cahaya katode ini memiliki kemampuan untuk memutar baling-baling yang diletakan di antara katode dan anode. Melalui penelitian tersebut, oleh Thomson kemudian ditarik kesimpulan bahwa sinar katode merupakan partikel yang menyusun atom yang memiliki muatan negatif dan kemudian disebut sebagai elektron.
Kelebihan teori atom thomson adalah partikel yang bersifat netral, sebab elektron yang dimilikinya memiliki muatan negatif. Supaya muatan negatif ini menjadi netral maka harus ada partikel lain yang bermuatan positif. Hal ini kemudian berhasil mematahkan teori Dalton, dan kemudian dikenal sebagai teori Thomson.
Sedangkan kekurangan teori atom thomson adalah tidak dapat menjelaskan fenomena hamburan alfa, yaitu dimana alfa dapat dipantulkan oleh lembaran tipis dengan sudut yang cukup besar.
3. Teori Atom Rutherford (Ernest Rutherford)
Teori berikutnya kemudian dilakukan oleh Rutherford yang pada masanya melakukan suatu percobaan yang sangat terkenal, dan bahkan masih terkenal sampai sekarang. Percobaan tersebut dilakukan bersama dengan dua muridnya yakni Hans Geiger dan juga Marsden.
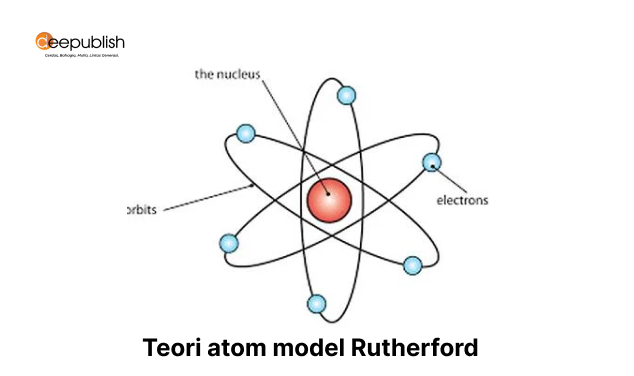
Rutherford yang memiliki nama lengkap Ernest Rutherford melakukan percobaan penembakan sinar alpha ke permukaan sebuah logam. Logam yang digunakan adalah lempengan emas tipis. Sinar alfa dijadikan percobaan karena memiliki kemampuan menembus kertas yang tipis.
Percobaan ini bertujuan untuk membuktikan teori atom yang dikemukakan oleh Thomson bahwa atom adalah bola pejal atau tidak. Sehingga saat sinar alfa ditembak ke permukaan lempengan emas tipis ini apakah akan berbelok atau justru menembus lempengan emas tersebut.
Melalui percobaan sinar alfa yang kemudian dikenal sebagai percobaan Geiger Marsden tersebut diketahui partikel sinar alfa ada yang menembus dan ada yang berbelok. Melalui hasil penelitian tersebut kemudian bisa ditarik beberapa kesimpulan:
- Atom pada dasarnya bukanlah bola pejal, sebab hampir seluruh sinar alfa yang ditembak ke permukaan benda tipis akan diteruskan.
- Jika lempengan emas tipis di dalam percobaan dianggap sebagai satu lapisan atom. Maka di dalam lapisan emas tersebut terdapat partikel dengan muatan positif.
- Partikel bermuatan positif tersebut yang kemudian diketahui menyusun inti atom. Sebab ada 1 dari 20.000 partikel sinar alfa yang membelok, dan dari angka tersebut diketahui perbandingan ukuran antara inti atom dengan partikel yang mengitarinya. yakni sekitar 10.000 kali lebih kecil.
Kelebihan teori atom rutherford adalah dapat menjelaskan tentang keberadaan inti atom yang memiliki muatan yang positif.
Sedangkan kekurangan teori atom rutherford adalah belum bisa menjelaskan kenapa elektron tidak jatuh ke permukaan inti atom. Padahal keduanya memiliki jenis muatan yang berbeda, yakni positif dan negatif.
4. Teori Atom Bohr (Niels Bohr)
Penyempurnaan kelemahan teori tentang atom yang dikemukakan oleh Rutherford kemudian dilakukan oleh Niels Bohr yang merupakan salah satu ahli fisika dari Denmark. Bohr diketahui melakukan percobaan menggunakan spektrum atom hidrogen.
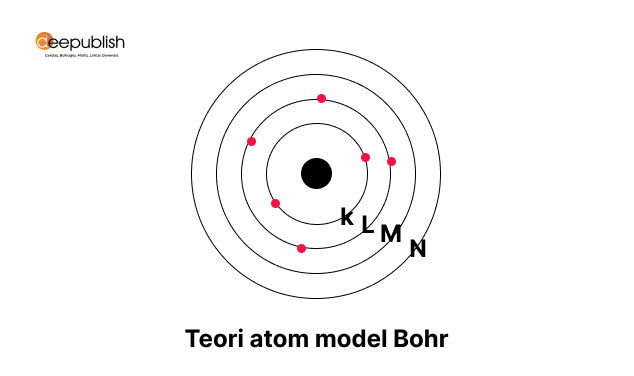
Melalui percobaan tersebut, Bohr mampu menjelaskan mengenai keberadaan elektron di sekitar inti atom. Bohr kemudian menjadi ilmuwan dan ahli fisika pertama yang bisa menyampaikan struktur atom yang dilakukan pada tahun 1913. Penamatan terhadap spektrum atom hidrogen kemudian bisa diketahui sifat atom.
Dari hasil penelitian yang menghasilkan teori atom terbaru tersebut kemudian diketahui sifat-sifat atom sebagai berikut:
- Atom terdiri dari inti atom yang memiliki muatan positif dan dikelilingi oleh elektron yang memiliki muatan negatif dan terdapat dalam satu lintasan.
- Elektron diketahui memiliki kemampuan untuk berpindah dari satu lintasan ke lintasan yang lain, dan menyerap atau memancarkan energi. Sehingga atom tidak akan kekurangan energi.
- Elektron yang berpindah dari lintasan lebih tinggi akan menyerap energi energi. Sedangkan jika elektron berpindah ke lintasan lebih rendah maka akan memancarkan energi.
- Kedudukan elektron dalam inti atom kemudian memiliki tingkatan energi yang berbeda di setiap lintasan, dan pada tingkat tertentu elektron ini kemudian disebut sebagai kulit-kulit elektron.
Kelebihan teori atom Bohr adalah mampu menjawab kelemahan dari teori atom rutherford dengan mengaplikasikan teori kuantum. Melalui pengamatan yang dilakukan oleh Bohr tersebut maka bisa diketahui bahwa atom memiliki beberapa lapisan kulit. Dimana setiap kulit ini mengandung atau memiliki elektron yang bermuatan negatif.
Sedangkan kelemahan teori atom Bohr adalah radius dan orbit yang bertentangan atau tidak sesuai dengan Prinsip Ketidakpastian Heisenberg. Prinsip tersebut menyatakan bahwa di dalam radius tidak akan dijumpai adanya orbit.
Rekomendasi Buku Kimia

| 
|

|
| Buku Kimia Dasar Mahasiswa Milenial | Buku Diktat Asas Teknik Kimia | Buku Kimia Ajar Berbasis Etnosains |
Dapatkan Buku-Buku Kuliah Kimia Lainnya di Buku Kimia
5. Teori Atom Modern (Werner Heisenberg dan Erwin Schrödinger)
Setelah melewati abad ke-20, teori atom kemudian mengalami masa dimana semakin terang benderang. Dikatakan demikian karena penelitian dan pengamatan paling baru terus berkembang dan semakin sempurna dalam menjelaskan bentuk fisik dari atom itu sendiri.
Model atom atau bentuk atom yang kemudian diyakini oleh masyarakat modern atau masyarakat saat ini, termasuk juga kita. Pada dasarnya merupakan teori yang dikemukakan oleh Erwin Schrodinger dan menyempurnakan teori dari Bohr, teori modern ini pertama kali dikemukakan pada 1926 dan berlaku sampai sekarang.
Oleh Schrodinger kemudian dijelaskan bahwa partikel tidak hanya berbentuk gelombang, namun juga gelombang probabilitas. Kedudukan dari elektron yang melingkari atau mengelilingi inti atom pada dasarnya tidak pasti. Sehingga kedudukan yang dimiliki masuk ke dalam kategori gelombang probabilitas.
Sehingga tidak mungkin bisa menemukan kedudukan pasti dari suatu awan elektron yang mengelilingi inti atom. Satu hal yang bisa disimpulkan adalah kedudukan tersebut merupakan kebolehjadian elektron, sehingga kedudukannya tidak pasti dan tidak dapat ditetapkan ada di lintasan dan kulit bagian mana.
Partikel yang Menyusun Sebuah Atom

Melalui penjelasan detail mengenai perkembangan teori atom di atas, kemudian bisa kita ketahui apa saja partikel yang menyusun sebuah atom. Lebih tepatnya struktur dari atom tersebut seperti apa. Diketahui ada tiga partikel yang menyusun struktur atom, yaitu:
1. Elektron
Partikel pertama adalah elektron yang diketahui sebagai sub partikel dari sebuah atom dan memiliki muatan listrik negatif. Partikel ini kemudian diketahui juga sebagai sub partikel yang paling ringan jika dibandingkan dengan sub partikel lainnya. Bahkan Saking ringannya elektron maka massa ditentukan oleh massa partikel lain.
2. Proton
Partikel berikutnya yang menyusun atom adalah proton, dan proton sendiri merupakan partikel dengan muatan positif. Massa yang dimiliki partikel proton ini adalah sama dengan massa pada hidrogen. Letak atau kedudukan proton ada di dalam inti atom dan berada di lapisan terjauh.
Oleh sebab itu, partikel ini tidak mudah terpengaruh oleh partikel lain di dalam atom. Proton dengan karakter ini kemudian menjadi satu-satunya partikel dari atom yang stabil.
3. Neutron
Partikel berikutnya adalah neutron dan diketahui merupakan sub partikel yang tidak memiliki muatan. Sehingga neutron ini sifatnya netral, tidak seperti elektron maupun proton. Tidak semua atom memiliki neutron, contohnya adalah atom pada hidrogen. Sehingga partikel yang menyusun atom di dalamnya tidak mengandung neutron.
Kesimpulan
Itulah artikel dari deepublihstore teori atom yang berkembang dari masa ke masa melalui penjelasan di atas. Pemahaman ini tidak hanya untuk ilmu saja, namun juga bisa dimanfaatkan untuk berbagai hal.



